がん免疫療法コラム


抗体の利用と抗体医薬品 【バイオ後続品、バイオシミラーとは何か】 《Part.6》
最近はすっかりジェネリック医薬品が定着したようで、CMでもその名称を耳にするようになって久しく、使用されている方も多いと思います。実に普及率は7割を超えています。前回、最後に話しましたように、抗体医薬品にもバイオ後続品(以下、バイオシミラー)と呼ばれるジェネリック医薬品が存在します。
ところが、このバイオシミラー、諸事情があって一般のジェネリック医薬品とは区別されています。2014年に本邦初のバイオシミラーが承認されたばかりなので、医療関係者以外の方で、この辺りの事情に関してご存じの方はあまりいないのではないでしょうか。しかし、今後、さらに抗体医薬品の開発が進めばバイオシミラーも普及することになり、ジェネリック医薬品と同様にバイオシミラーに対する理解も必要になってきます。
では、このバイオシミラーは、なぜ一般のジェネリック医薬品と区別されているのでしょうか?一体、何が違うのでしょうか?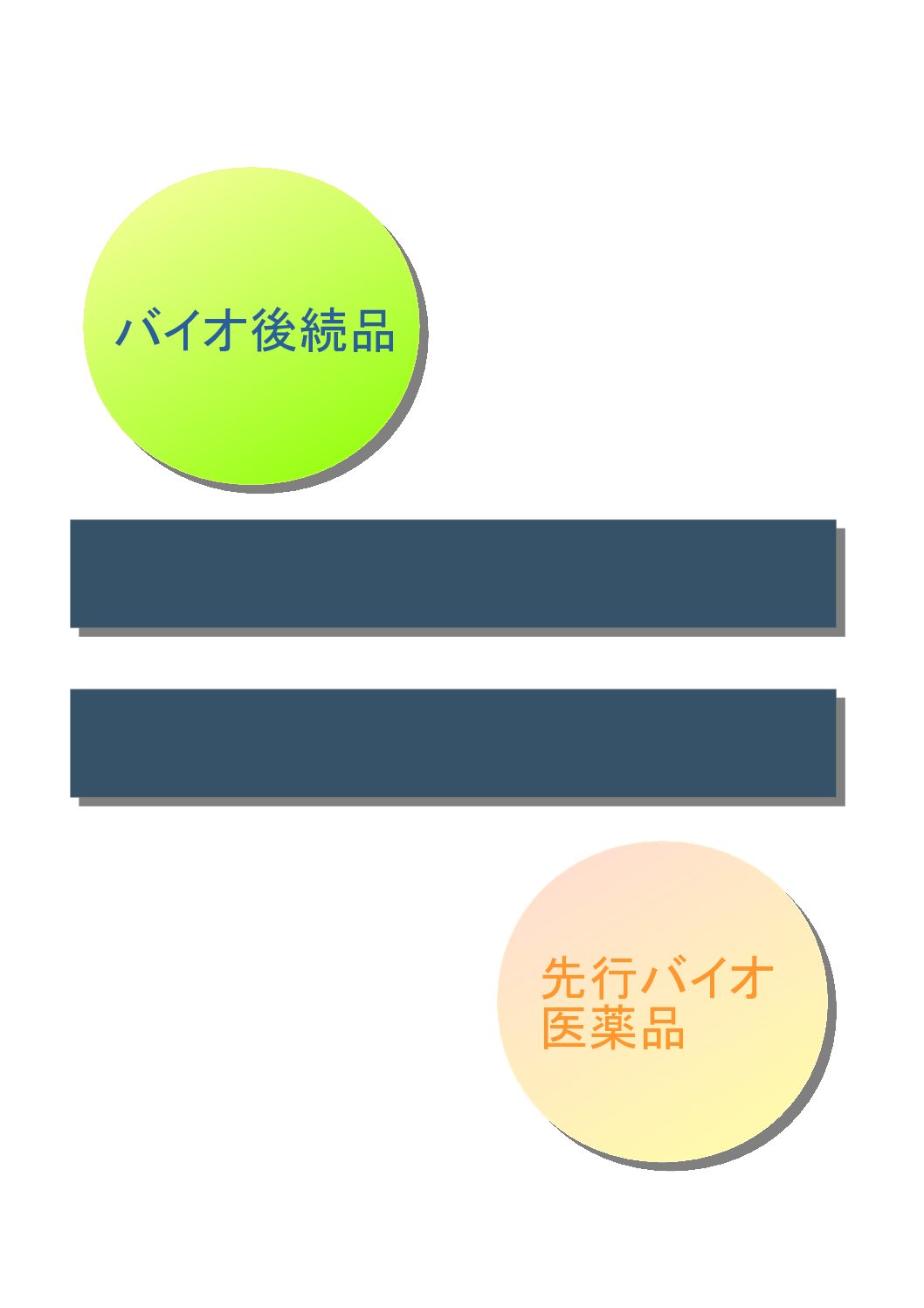
■バイオシミラーの定義
まずここで、一般のジェネリック医薬品の定義を見てみましょう。
厚生労働省の資料には「先発医薬品と同一の有効成分を同一量含み、同一経路から投与する製剤で、効能・効果、用法・用量が原則的に同一であり、先発医薬品と同等の臨床効果・作用が得られる医薬品」となっています。
一方、バイオシミラーの定義は「新有効成分含有医薬品として承認されたバイオテクノロジー応用医薬品(先行バイオ医薬品)と同等/同質の品質、安全性および有効性を有する医薬品」となっています。
両者は同じ後発薬品ですが、ジェネリック医薬品では先発医薬品と「同一」という言葉が使われているに対し、バイオシミラーでは先行バイオ医薬品と「同等/同質」という言葉が使われています。これは一体何を意味しているのでしょうか?
■ジェネリック医薬品とバイオシミラーの相違
◆「同一」と「同等/同質」の違い
この場合の「同一」とは、全く同じ有効成分が含まれているという意味です。一方の「同等/同質」とは、先行バイオ医薬品に対して類似性が高いと言う意味であり、仮に何らかの差異があったとしても、製品の品質や安全性および有効性に影響を及ぼさないと科学的に判断できる場合を示します。
何だかちょっと複雑ですが、具体的には薬の品質や効果および安全性を調べるための基礎実験や臨床試験を行い、その結果を用いて先行バイオ医薬品との類似性を示すことが要求されます。一方のジェネリック医薬品でも実験などを行う必要はありますが、バイオシミラーに比べれば限られています。
つまり、バイオシミラーが製造承認を取得するには、先行バイオ医薬品に対する類似性を示すために一般のジェネリック医薬品よりも多くの要件が課されるのです。この点が異なるところです。その結果、多くの手間と時間がかかってしまいます。
◆「同等/同質」を示すことの意味
では、なぜ、バイオシミラーは「同一」ではなく、「同等/同質」、つまり類似性を示す必要があるのでしょうか?
抗体医薬品はタンパク質などの高分子化合物(分子量約10,000以上)で出来ているため、分子量が大きく、また構造的にも複雑です。そのため全く「同一」の化合物を製造することが出来ず、それに近い類似の化合物を製造することになります。これがバイオシミラーであり、品質や安全性および有効性などが先行バイオ医薬品と全く同じになるとは限らないのです。
一般の医薬品の多くは低分子化合物(分子量約1,000以下)で出来ており、構造も比較的単純なので全く同じ有効成分を製造することが可能です。だから、ジェネリック医薬品は先発医薬品と同一であることが求められるのです。そしてまた、それを示すことに対してさほどの困難を伴わないのです。
つまりは、バイオシミラーは先行バイオ医薬品と「同一」とは言えないため、「同等/同質」を検証して類似性を示すことで、一般のジェネリック医薬品のような役割を認めて行こうという一種の救済策と言っても良いかも知れません。
■バイオシミラーの課題
ところが、この救済策に伴う一連のプロセスは開発コストを上昇させ、それが価格に反映されてしまっているのです。ジェネリック医薬品の価格が先発医薬品の2~5割なのに対し、バイオシミラーでは7割とそれほど安くはなっていません。これには前回ご説明した製造コストが高いことも影響しています。バイオシミラーは患者負担の低減および医療費削減という役割を担っていることから、これらの開発コストと製造コストから派生する価格の問題は大きな課題と言えます。
しかし、世界的な傾向としてバイオシミラーの市場は広がっており、また、「経済財政運営と改革の基本方針2017」によると、バイオシミラーに関して2020 年度(平成32 年度)末までに品目数の倍増(成分数ベース)を目指すとしています。このような政府の後押しも加わり、本邦においても間違いなく市場の拡大が見込まれるため、この動向がより安価な製品の創製への追い風になるものと期待されます。
参考文献
- 厚生労働省, ジェネリック医薬品への疑問に答えます~ジェネリック医薬品Q&A https://www.mhlw.go.jp/seisakunitsuite/bunya/kenkou_iryou/iryou/dl/jene-qa.pdf
- 国立医薬品食品衛生研究所 生物薬品部ホームページ http://www.nihs.go.jp/dbcb/biosimilar.html#b02
- 日医工株式会社ホームページ, バイオシミラーと後発医薬品はどう違うの? https://www.nichiiko.co.jp/biosimilar/08_difference.html
- 平成21年3月4日付け 薬食発第0304004号 医薬食品局長通知「バイオ後続品の承認申請について」http://www.nihs.go.jp/dbcb/TEXT/yakusyokuhatu-0304004.pdf
- 厚生労働省におけるバイオ医薬品の使用促進に係る普及啓発等事業について http://www.nihs.go.jp/dbcb/15rsforum/15rsforum-yamate.pdf