がん患者様のためのお役立ちブログ


制御性T細胞とは?がんとの関係やがん免疫療法について解説
がん免疫の研究は、この数十年で大きく進歩しました。その原動力のひとつとなったのが、「制御性T細胞(RegulatoryTcell:Treg)」の発見です。
この細胞を発見・命名したのは、2025年にノーベル生理学・医学賞を受賞した京都大学名誉教授・坂口志文氏です。
坂口氏の研究によって、免疫には「外敵を攻撃する働き」だけでなく、「過剰な反応を抑えて体を守る仕組み」があることが明らかになりました。
本来、制御性T細胞は自己免疫疾患などを防ぐ「ブレーキ役」として重要な存在ですが、がんの世界ではこの機能が裏目に出ることがあります。がん細胞が制御性T細胞を利用して免疫の働きを抑え、「免疫から逃れる」メカニズムをつくり出しているのです。
この記事では、制御性T細胞の基本的な働きから、がんとの関係、そして免疫療法の最新研究までをわかりやすく解説します。
【がんの治療の選択肢としておすすめしたい「6種複合免疫療法」】
副作用が少なく、他の治療と併用できる!
6種複合免疫療法は、患者さま自身の免疫細胞を一度体外へ取り出し、活性化・増殖させて体内へ戻すことで、がんと闘う力を高める免疫療法です。
治療法は採血と点滴だけの通院治療です。
6種複合免疫療法をおすすめする理由
- がん3大療法との併用が可能で、ほぼ全てのがんに対応する
- 副作用が少ないため、体への負担も小さい治療法である
- 入院が必要ないため、患者さまの生活のリズムを変えることなく治療を行うことができる
がん治療の選択肢の一つとして、6種複合免疫療法もぜひご検討ください。
今すぐ詳細を知りたい方は、以下よりお問い合わせください。
INDEX
制御性T細胞とは
私たちの体には、ウイルスや細菌などの異物を攻撃する「免疫」という防御システムが備わっています。この免疫を担う代表的な細胞が「T細胞」です。
T細胞には、がん細胞や病原体を攻撃する「攻撃型」の働きを持つものもあれば、逆に免疫の暴走を防ぐ「ブレーキ役」として働くタイプも存在します。
この「免疫のブレーキ」を担うのが、制御性T細胞(RegulatoryTcell:Treg)です。
制御性T細胞は、免疫が過剰に反応して自分の体を攻撃してしまう「自己免疫反応」を防ぎ、アレルギーや炎症を抑えるなど、体内の免疫バランスを保つ重要な役割を果たしています。
健康な状態では、この「攻撃」と「制御」のバランスが取れており、必要なときに免疫が働き、不要なときは制御性T細胞がブレーキをかけることで体の恒常性が保たれています。
ノーベル生理学・医学賞を受賞した坂口氏の研究
制御性T細胞(RegulatoryTcells,Tregs)の存在を明確に示したのが、京都大学名誉教授の坂口志文氏です。
坂口氏は1995年、CD4⁺CD25⁺T細胞という免疫の抑制機能を持つ特定のT細胞集団(制御性T細胞)をマウスを用いた研究で同定し、その存在を明確に示しました。
その後、2003年、坂口氏らはFOXP3遺伝子が制御性T細胞の発生と抑制機能の司令塔であることを発見し、これが制御性T細胞を特定する代表的な分子マーカーとなりました。
坂口氏の研究は、免疫学に次のような新しい理解をもたらしました。
- 自己免疫疾患(例:関節リウマチ、1型糖尿病など)は、制御性T細胞の異常や機能低下によって起こる場合がある
- 免疫システムは「攻撃」と「抑制」の両面が適切に働くことで健康を維持している
- がんや感染症など、免疫反応の調整を目指した新しい治療戦略の発展につながった
こうした功績が認められ、坂口志文氏は2025年にノーベル生理学・医学賞を受賞しました。
受賞理由は「免疫応答の自己制御機構の発見と、制御性T細胞を介した免疫恒常性の維持機構の解明」であり、その研究が高く評価されたものです。
坂口氏の研究は、免疫学の常識を覆し、自己免疫疾患治療やがん免疫療法を発展させる画期的な成果として、現在も世界中で応用研究が進められています。
制御性T細胞とがんの関係
制御性T細胞は、本来「免疫の暴走を防ぐ」ために働く重要な細胞ですが、がんの領域では、この仕組みが逆に悪用されてしまうことが知られています。
がん細胞は、免疫から攻撃されないように周囲の環境を変化させ、制御性T細胞を増やしたり、その働きを強めたりすることで、免疫のブレーキを強制的にかけてしまうのです。
この結果、本来ならがんを攻撃すべきT細胞(キラーT細胞など)が十分に働けなくなり、がんが免疫から逃れてしまう状態、いわゆる「免疫逃避(immuneescape)」が起こります。
この仕組みを逆手に取ったのが、がん免疫療法です。
例えば、免疫チェックポイント阻害薬(例:ニボルマブ〈オプジーボ®〉やペムブロリズマブ〈キイトルーダ®〉)などは、制御性T細胞やその関連経路に働きかけ、ブレーキを解除して免疫を再び活性化させることで、がん細胞を攻撃できるようにします。
近年では、さらに一歩進んで、以下のような制御性T細胞そのものを標的とした新しい治療法の研究も進められています。
- 制御性T細胞を一時的に減らす薬剤
- FOXP3を抑制して免疫活性を回復させる方法
- 制御性T細胞の性質を変化させ、がんを攻撃するT細胞へ転換させる試み
このように、制御性T細胞は「がんを抑える側」にも「がんに利用される側」にもなりうる、免疫のバランスを左右する二面性をもった存在です。
この細胞をいかに制御するかが、今後のがん免疫療法の発展を大きく左右すると考えられています。
その他のT細胞

制御性T細胞が「免疫のブレーキ役」として働く一方で、体内には「免疫のアクセル」となるT細胞も存在します。
この「アクセル」の役割を主に担うのが、ヘルパーT細胞(CD4⁺T細胞)とキラーT細胞(CD8⁺T細胞)の2種類です。どちらも免疫反応を活性化し、病原体やがん細胞を排除する中心的な役割を担っています。
これらのT細胞はそれぞれが異なる機能を持ちながら協力し合うことで、免疫システムを成り立たせているのです。
ヘルパーT細胞
ヘルパーT細胞は、免疫全体の命令を出す「司令塔」のような存在です。
体内で異常を察知すると、他の免疫細胞(B細胞・マクロファージ・キラーT細胞など)に命令を送り、攻撃体制を整えます。
ヘルパーT細胞の主な働きは以下の通りです。
- 外敵を発見した際に、抗体をつくるB細胞や攻撃を行うキラーT細胞を活性化させる
- インターロイキン(IL)などの情報伝達物質を放出し、免疫細胞間の連携を促す
- 感染やがん細胞への反応を高める一方、過剰反応が起きないようバランスを取る
ヘルパーT細胞にはさらに細かなサブタイプ(Th1、Th2、Th17など)があります。
例えばTh1型はウイルス・がん細胞への免疫を強め、Th2型はアレルギーや寄生虫感染への防御を担います。このバランスが崩れると、免疫が過剰になったり(アレルギー)、逆に弱くなったり(感染やがん)します。
がん免疫の分野では、Th1型ヘルパーT細胞の活性化が治療効果に関与するとされており、免疫療法やワクチン治療でも、この細胞をいかに誘導するかが注目されています。
キラーT細胞
キラーT細胞(細胞障害性T細胞)は、がん細胞やウイルス感染細胞を直接攻撃する「実行部隊」です。
ヘルパーT細胞の指令を受けて活性化し、異常な細胞を特定して排除します。
キラーT細胞の主な働きは以下の通りです。
- がん細胞表面の抗原(異常なたんぱく質)を認識し、ピンポイントで攻撃
- 攻撃対象の細胞に自滅信号を送り、自然に死滅させる
- 一度出会ったがん細胞やウイルスを記憶し、再発時にすばやく反応
キラーT細胞の働きが低下すると、がん細胞が免疫から逃れやすくなり、病気の進行や再発リスクが高まります。そのため、がん免疫療法の多くはキラーT細胞をいかに活性化させるかを目的としています。
例えば、免疫チェックポイント阻害薬は、キラーT細胞にかかった「ブレーキ」を外し、再び攻撃力を取り戻させる治療法です。
また、近年ではCAR-T細胞療法のように、患者さま自身のT細胞を遺伝子改変して再注入し、がん細胞をより的確に狙い撃つ先進的な治療も実用化されています。
免疫のブレーキを「外す」がん免疫療法

がん免疫療法には、免疫チェックポイント阻害薬に代表される「免疫のブレーキを外す」という治療戦略があります。
私たちの体には、免疫が暴走しないようにする「免疫抑制機構」というブレーキが備わっています。
がん細胞はこの仕組みを利用し、T細胞の働きを止めてしまう(ブレーキをかける)ことで、免疫による攻撃を回避しているのです。
そこで、そのブレーキを「外す」ことによって、T細胞が本来の力を取り戻し、再びがんを攻撃できるようにするのが、この治療法の基本的な考え方です。
免疫チェックポイント阻害薬
現在、最も広く臨床で使われているがん免疫療法が免疫チェックポイント阻害薬です。
T細胞の表面には「PD-1」「CTLA-4」といったブレーキ役のたんぱく質(免疫チェックポイント)が存在します。
がん細胞は、これらに対応する分子(PD-L1など)を発現させてT細胞の働きを止め、免疫の攻撃を回避しようとします。
免疫チェックポイント阻害薬は、この「ブレーキがかかる部分(結合部分)」を薬剤がブロックすることで、T細胞が再びがんを攻撃できるようにする治療法です。
主な薬剤と対象がんは以下の通りです。
| 薬剤名 | 標的分子 | 主な対象がん |
| ニボルマブ(オプジーボ®) | PD-1 | 悪性黒色腫、肺がん、腎がんなど |
| ペムブロリズマブ(キイトルーダ®) | PD-1 | 胃がん、乳がん、子宮頸がんなど |
| アテゾリズマブ(テセントリク®) | PD-L1 | 肺がん、膀胱がんなど |
| イピリムマブ(ヤーボイ®) | CTLA-4 | 悪性黒色腫など |
注意点: この治療法は、免疫のブレーキを外すという特性上、免疫が正常な組織を攻撃してしまう「自己免疫反応」が起こる場合があります。その結果、発熱・皮膚炎・甲状腺異常・腸炎など、自己免疫性の副作用が現れることがあります。
抗CCR8抗体療法
抗CCR8抗体療法は、制御性T細胞(Treg)を選択的に抑える新しい免疫療法として研究が進められています。
制御性T細胞は免疫のブレーキ役ですが、がんの周囲では過剰に働いてT細胞の攻撃力を低下させてしまうことがあります。
「CCR8」という分子が、がん局所の制御性T細胞に多く発現していることが分かっており、このCCR8を抗体でブロックすることで、Tregだけを選択的に抑制して免疫を再活性化するのがこの療法の狙いです。
抗CCR8抗体療法は、全身の免疫バランスを大きく崩さず、がん局所のみで免疫抑制を解除できる可能性があります。
現在は臨床試験段階であり、免疫チェックポイント阻害薬と組み合わせる併用療法として期待されています。
このように、「免疫のブレーキを外す」領域では、PD-1/CTLA-4阻害薬に加え、CCR8・LAG-3・TIM-3など新しい分子標的の研究も進行中です。
免疫のアクセルを「踏む」がん免疫療法
一方で、免疫を抑えるブレーキを外すだけでは十分な治療効果が得られない場合もあります。
そのような時には、免疫細胞の働き自体を強め、「アクセルを踏む」タイプの免疫療法が重要です。これは、患者さま自身の免疫細胞を体外で増やしたり、活性化させたりしてから体内に戻し、がんに対する攻撃力を高める治療法の総称です。
アルファ・ベータT細胞療法
アルファ・ベータT細胞療法は、患者さま自身の血液からT細胞(アルファ・ベータT細胞)を採取し、体外で活性化・増殖させてから再び体内に戻す治療法です。
「がんと闘う力を高めたT細胞」を体外で増やしてから戻すことで、がん細胞への攻撃力をブースト(強化)します。
6種複合免疫療法
6種複合免疫療法は、単一の細胞だけでなく、役割の異なる6種類の免疫細胞を組み合わせて活性化させる多角的な免疫療法です。
T細胞だけでなく、NK細胞や樹状細胞など、がんを攻撃するさまざまな細胞を同時に強化し、がんに対する総合的な免疫反応を高めます。
使用される免疫細胞は以下の通りです。
| 細胞の種類 | 主な働き |
| NK細胞 | がんを見つけ次第、退治する |
| 樹状細胞 | 敵(がん)の情報を入手し、攻撃目標を伝達 |
| キラーT細胞 | 指令に忠実に働く |
| NKT細胞 | 自らも闘う、がん治療の究極の助っ人 |
| γδT細胞 | 抗腫瘍作用でがんを退治する |
| ヘルパーT細胞 | 免疫の司令塔となる |
このように、複数の免疫細胞で全体を底上げするアプローチは、単一の細胞(T細胞のみ)を増やす療法と比べ、がんの多様な性質に対応できる可能性があります。
副作用が少ない6種複合免疫療法

「6種複合免疫療法」の特徴を3つ紹介します。
①副作用が少なく、体への負担が小さい
患者さま自身の免疫細胞を利用するため、抗がん剤のような強い副作用はほとんどありません。他の治療で継続が難しいと判断された場合でも、治療を続けられる可能性があります。
②がん3大療法との併用が可能で、ほぼ全てのがんに対応
外科手術・化学療法・放射線治療と組み合わせることができ、一部の血液がん(T細胞・NK細胞・NKT細胞型白血病/悪性リンパ腫)を除き、ほぼすべてのがんに適応可能です。
さらに、手術後に残ったがん細胞の抑制や、再発・転移の予防にも効果が期待できます。
③入院の必要なし。採血と点滴だけの通院治療
入院を必要とせず、採血と点滴で進められるため、患者さまの生活リズムを大きく変えることなく治療を受けられます。
6種複合免疫療法の治療効果
以下は、6回(1クール)の治療を終えた患者さまの治療効果を紹介します。
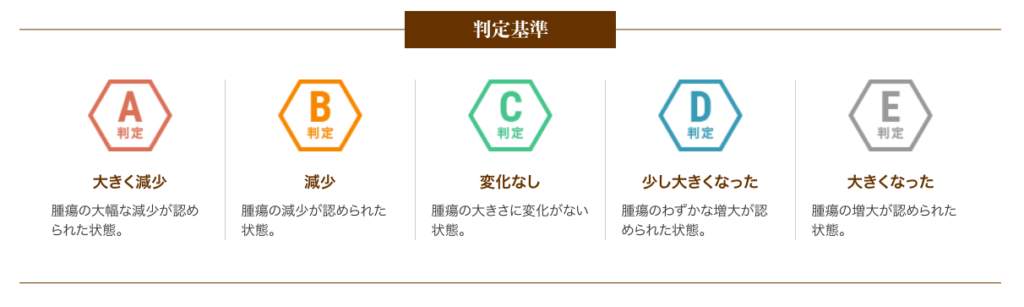

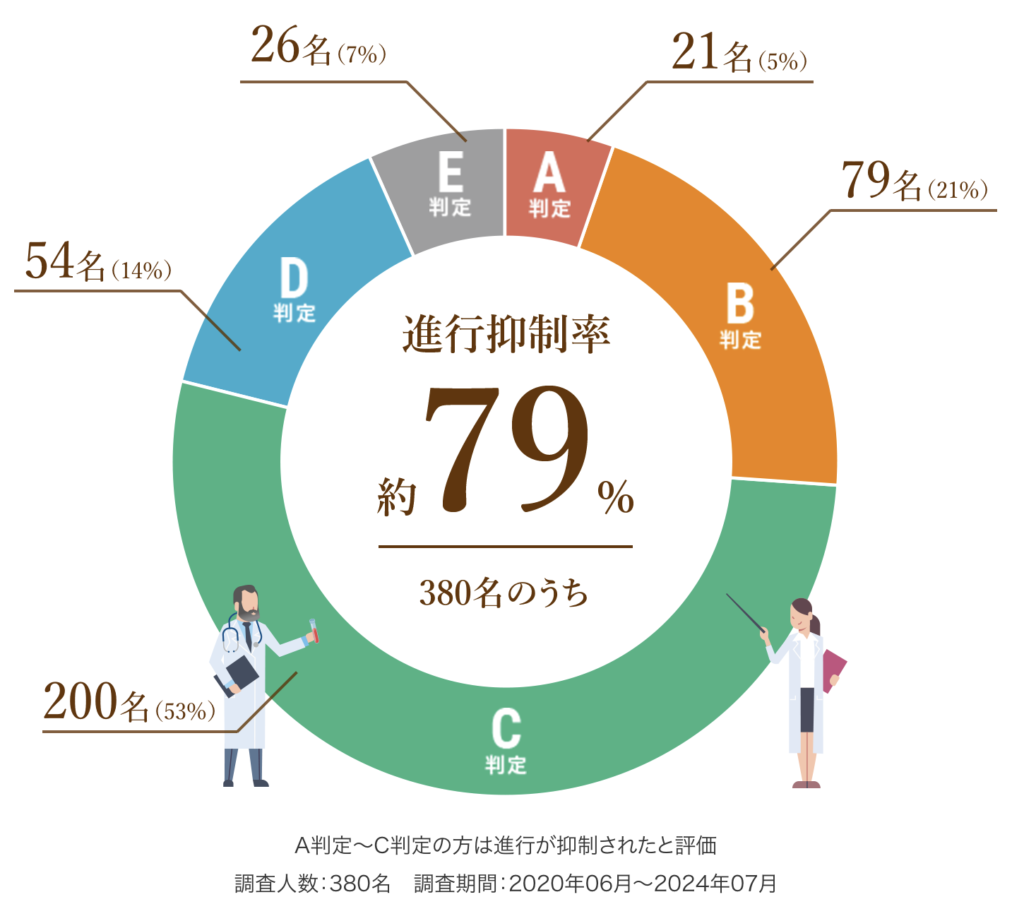
A判定〜C判定の約79%の方は腫瘍の進行が抑制されたと評価し、さらにA判定〜B判定の約26%の方は腫瘍の減少が認められた状態となりました。
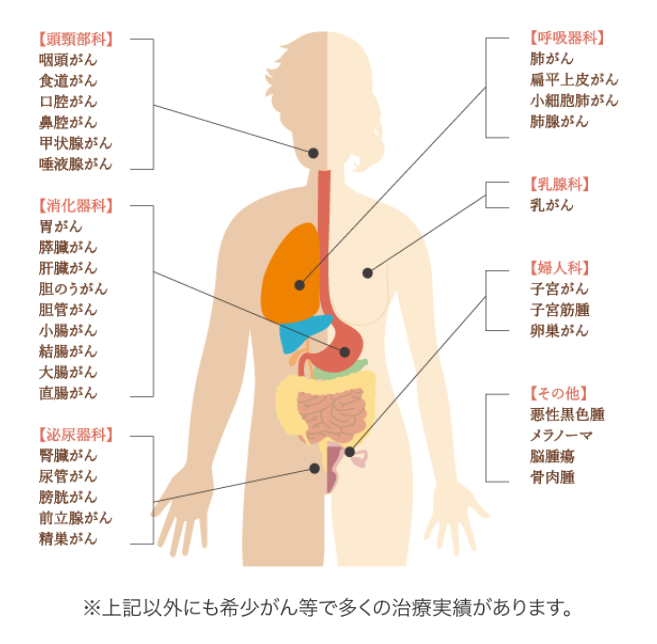
また、6種複合免疫療法の大きな特徴として、さまざまな部位のがんに対応できるという点があります。
以下、6種複合免疫療法で過去に治療したがんの一例です。ほぼ全てのがん種に対応しているため、以下に記載のないがん種や希少がんでも、治療可能です。
6種複合免疫療法の2つのコース
「CSC」
がん治療をご希望の方や、過去にがんの経験がある患者様には、6種複合免疫療法「CSC」をご提供します。
「CSC」では、免疫チェックポイント阻害薬を付加する「チェックポイントガード」のオプションを追加することができます。
免疫チェックポイント阻害薬は、がん細胞が免疫細胞の働きを抑制することを防ぐ薬です。6種複合免疫療法「CSC」と組み合わせることで、投与した免疫細胞の闘う力を最大限に引き出し、6 種複合免疫療法単独での治療に比べて高い治療効果が期待できます。
「BASIC」
がんのリスクが心配な方にはがん予防のための6種複合免疫療法「BASIC」をご提供します。6種類の免疫細胞を培養して活性化・増殖し、これらの免疫細胞を体の中に戻すことで、がんの発生リスクを低減します。
詳細は以下よりお問い合わせください。
FAQ
ここでは、制御性T細胞について、患者さまやご家族からよく寄せられる質問にお答えします。
Q:制御性T細胞は別名何といいますか?
A:制御性T細胞は、「Treg(ティーレグ)細胞」とも呼ばれます。英語では「RegulatoryTcell(レギュラトリーTセル)」といい、その略称が「Treg」です。
この細胞は、免疫反応を抑える働きを持つことから、かつては「抑制性T細胞(SuppressorTcell)」と呼ばれていた時期もありました。しかし、その後の研究で機能や仕組みがより明確になり、現在では「制御性T細胞(Treg)」という名称が一般的に使われています。
お電話でのお問い合わせ
専任のスタッフが丁寧に対応いたします。
ご不明な点などございましたら、まずはお気軽にご相談ください。
0120-350-552
受付時間月曜〜金曜/09:00 - 18:00
土曜/09:00 - 13:00