がん患者様のためのお役立ちブログ


【2025年最新】がんの最新治療とは?治療の歴史と2025年最新情報まで解説
がん治療は長い歴史の中で、少しずつ、しかし着実に進化を遂げてきました。
現在は治療の選択肢が広がり、新しい治療法も増えてきています。
がん治療においては、最適な治療を選択するために最新の情報を調べることが重要です。
今回の記事では、1990年代から現在までのがん治療の進展を振り返りながら、最新の治療法について詳しく解説します。
【がんの治療の選択肢としておすすめする「6種複合免疫療法」】
副作用が少なく、他の治療と併用できる!
6種複合免疫療法は、患者さま自身の免疫細胞を一度体外へ取り出し、活性化・増殖させて体内へ戻すことで、がんと闘う力を高める免疫療法です。
治療法は採血と点滴だけの通院治療です。
6種複合免疫療法をおすすめする理由
- がん3大療法との併用が可能で、ほぼ全てのがんに対応する
- 副作用が少ないため、体への負担も小さい治療法である
- 入院が必要ないため、患者さまの生活のリズムを変えることなく治療を行うことができる
がん治療の選択肢の一つとして、6種複合免疫療法もぜひご検討ください。
INDEX
がんの治療法の歴史

がんの治療法は時代とともに進化し、患者さまのがん根治と生活の質(QOL)の向上を目的とし、研究されてきました。
20世紀初頭までは手術療法が主流でしたが、その後、放射線療法や化学療法が導入され、治療の選択肢が広がりました。
以下、1990年代から現在までのがん治療の歴史について詳しく解説します。
1990年代最新のがん治療
1990年代は、がん治療が大きく進歩した時代でした。
従来の手術、放射線療法、化学療法の技術が洗練されるとともに、新たな治療法が研究・導入され、患者さまの生存率向上や副作用の軽減に寄与しました。
また、分子生物学の発展により、がんの遺伝子異常が明らかになった時期でもあります。
個別化医療の基礎も、この頃築かれました。
この時代の進歩は、現在のがん治療における重要な礎となっています。
化学療法の進化
1990年代には、複数の抗がん剤を組み合わせる「多剤併用療法」が一般的になりました。この方法は、性質の異なるがん細胞に対応し、治療効果の向上を目的としています。
特に乳がんや肺がん、白血病において新たな薬剤が開発され、治療の選択肢が広がりました。
乳がんの治療では、ホルモン療法と化学療法が組み合わされるようになり、1990年代にはタモキシフェンが標準治療として確立され、ホルモン受容体陽性の乳がんに対する有効な治療法として広く使用されます。
また、大腸がんの治療にはイリノテカンが導入され、化学療法の効果が向上しました。
放射線治療の精度向上
放射線治療では、コンピュータ技術の進化により、より精密な治療が可能になりました。
CTスキャンやMRIを用いた三次元原体照射(3D-CRT)が開発されました。これにより、腫瘍の形状に合わせた放射線の照射が可能になりました。
さらに、周囲の正常組織を保護しながら、がん細胞に集中的に放射線を当てることができます。
また、1990年代の終盤には、強度変調放射線治療(IMRT)の研究が進められました。
2000年代に入ると実用化が進み、照射の強度を調整しながら腫瘍に最適な線量を投与する技術が確立されました。
免疫療法の初期研究

1990年代は、免疫療法の概念が確立され始めた時期でもありました。
この時代には、免疫チェックポイントという考え方が登場し、がん細胞が免疫系の攻撃を回避する仕組みが研究されました。
この流れの中で、1997年にはリツキシマブ(リツキサン)が米国の食品医薬局(FDA)により非ホジキンリンパ腫に対する治療薬として承認されました。その後、日本でも2001年に承認されました。
リツキシマブはモノクローナル抗体を利用した治療法であり、がん細胞に特異的に結合して攻撃するという新しいメカニズムを持っています。
この技術は、その後の免疫チェックポイント阻害薬やCAR-T細胞療法など、より高度な免疫療法の開発につながる基盤となりました。
ホルモン療法の発展
ホルモン療法もこの時代に大きく進化しました。
特に乳がんや前立腺がんにおいて、ホルモン受容体を標的とした治療法が確立されます。
乳がん治療ではタモキシフェンが長期間にわたり使用され、再発の抑制効果が示されました。
また、前立腺がんではLH-RHアゴニストと呼ばれるホルモン療法薬が広く使われるようになり、がん細胞の成長を抑えることが可能になりました。
遺伝子診断と分子生物学の進展
1990年代には、がん細胞における遺伝子異常の研究が進みました。
がんの発症や進行に関与する遺伝子(p53遺伝子やHER2遺伝子など)が特定され、個別化医療の概念が登場します。
特に乳がんにおいては、HER2陽性のがんに対する分子標的療法の研究が進められ、米国では1998年にトラスツズマブ(ハーセプチン)が承認され、日本においても2001年に承認されています。
これは、特定の遺伝子異常を持つがんに対する治療の実用化の始まりを示し、のちに多くのがん治療に応用されることになりました。
手術技術の革新
1990年代は、がん手術の技術も大きく進歩しました。
特に、内視鏡手術や腹腔鏡手術が発展し、患者さまの体への負担を軽減する低侵襲手術が普及しました。
これにより、手術後の回復が早くなり合併症のリスクも低減されました。
さらに、前立腺がんや消化器系のがんでは、ロボット支援手術(医師がロボット手術支援システムを操作しながら行う手術のこと)の研究が進み、より精密な手術が可能になりました。
2000年代最新のがん治療
2000年代に入ると、がん治療は従来の手術、放射線治療、化学療法に加えて、分子標的治療や免疫療法などの新しい治療法が加わり、治療の幅が大きく広がりました。
また、遺伝子解析技術の発展により、個々の患者さまに適した治療を提供する「個別化医療」の概念が定着しました。
分子標的治療の進展
2000年代、がん細胞の特定の遺伝子変異やタンパク質を標的とする「分子標的治療」が実用化されました。
この治療法は、従来の化学療法よりもがん細胞を狙いやすく、副作用を抑えつつ効果を発揮できるのが特徴です。
| 薬剤名 | 対象がん種 | 作用機序 | 承認年 |
| イマチニブ(グリベック) | 慢性骨髄性白血病(CML) | BCR-ABL融合遺伝子を標的にし、がん細胞の増殖を抑制 | 2001年(米国・日本) |
| トラスツズマブ(ハーセプチン) | HER2陽性乳がん | HER2タンパク質を標的にし、がん細胞の増殖を抑制 | 1998年(米国)、2001年(日本) |
| ベバシズマブ(アバスチン) | 大腸がん、肺がんなど | 血管新生を抑制し、腫瘍の成長を抑える | 2004年(米国)、2007年(日本) |
分子標的薬の登場により、従来の化学療法では治療が難しかったがんに対しても有効な治療法が確立されました。
特に、大腸がんや乳がんでは分子標的薬の使用が一般的になり、患者さまの生存率や生活の質の向上に大きく貢献しています。
免疫療法の革命
2000年代には、がん治療における免疫療法の重要性が増加し「免疫チェックポイント阻害薬」の開発が進みました。
がん細胞は、免疫系の攻撃を回避するために免疫チェックポイントを利用します。免疫チェックポイント阻害薬は、名前の通り、このがん細胞が免疫系の攻撃を回避する免疫チェックポイントを阻害することで免疫細胞(T細胞)ががん細胞を攻撃できるようにすることができます。
代表的な免疫チェックポイント阻害薬として、ペムブロリズマブ(キイトルーダ)やニボルマブ(オプジーボ)が開発されました。
これらは、PD-1と呼ばれる免疫抑制分子を阻害し、がん細胞への免疫攻撃を強化します。特に、非小細胞肺がんやメラノーマ(黒色腫)において劇的な効果を示しました。
また、2000年代後半には、1980年代後半に提唱され、研究が続けられていたCAR-T細胞療法の改良が進み、実用化が進みました。
これは、患者さまのT細胞を体外で遺伝子改変し、がん細胞を標的にする受容体を持たせてから再び体内に戻す治療法です。
2017年には、キムリア(Kymriah)やヤスカータ(Yescarta)といったCAR-T細胞療法が承認され、特に白血病やリンパ腫の治療に新たな選択肢を提供しました。
個別化医療(精密医療)の進展
がんの遺伝子情報をもとに最適な治療法を選択する「個別化医療(精密医療)」の考え方は、2000年代に広まりました。
個別化利用では、がんの進行に関与する遺伝子異常を解析し、それに応じた治療薬を選択することで、より効果的な治療が可能になります。
このアプローチの一環として、バイオマーカーを利用した治療選択が一般化しました。
例えば、乳がんではホルモン受容体(ER、PR)の発現やHER2の過剰発現を調べることで、ホルモン療法や分子標的療法の適応が判断されるようになりました。
同様に、非小細胞肺がんではEGFR遺伝子変異の有無を調べ、EGFR阻害薬(ゲフィチニブなど)の使用が決定されるようになります。
ロボット手術と低侵襲手術の進化

手術技術も2000年代に進化を遂げました。
ロボット支援手術(ダ・ヴィンチ手術など)が導入され、従来の開腹手術よりも精密で低侵襲な手術が可能になりました。
これにより、前立腺がんや消化器がんの手術において、合併症のリスクが低減し、患者さまの回復も早まりました。
また、内視鏡や腹腔鏡を用いた低侵襲手術も普及し、より患者さまの負担が少ない治療が可能になりました。
手術後の入院期間が短縮され、生活への影響を最小限に抑えることができるようになりました。
新しい放射線治療技術の登場
放射線治療の技術も進歩し、強度変調放射線治療(IMRT)が普及しました。
IMRTは、腫瘍の形状に合わせて放射線の強度を調整し、正常組織への影響を最小限に抑えることができる治療法です。
また、陽子線治療や重粒子線治療も2000年代に入って注目されるようになり、特定のがん種に対して高精度な放射線治療が可能になりました。
肺がん分子標的治療薬イレッサ事件とは
イレッサ(一般名:ゲフィチニブ)は、2002年に日本で世界に先駆けて承認された肺がんの分子標的治療薬です。
非小細胞肺がんの治療に新たな希望をもたらすと期待されましたが、発売直後から重篤な副作用である間質性肺炎による死亡例が相次ぎ、大きな社会問題となりました。
発売から約1年で180人以上が亡くなり、患者さまや遺族が製薬会社や国を相手に訴訟を起こす事態へと発展しました。
この事件をきっかけに、日本の新薬承認制度や医薬品の安全対策が大きく見直されることになりました。
イレッサ事件を受けて、新薬の承認プロセスは厳格化され、販売後の安全監視を強化するリスク管理計画(RMP)が導入されました。
また、がん治療において、患者さまごとの遺伝子変異を事前に調べる「個別化医療」の重要性が認識されるようになります。
特に、EGFR遺伝子変異を持つ患者さまに対してイレッサが有効であることが明らかになり、バイオマーカーを活用した分子標的治療が進化しました。
現在では、イレッサの後継となるより効果的で副作用の少ないEGFR阻害薬(アファチニブ、オシメルチニブなど)が登場し、治療選択肢が広がっています。
また、免疫チェックポイント阻害剤(オプジーボやキイトルーダ)などの新しい治療法も加わり、肺がん治療はさらに発展しています。
イレッサ事件は、安全で効果的ながん治療を確立するための重要な転換点となり、現在の最新医療へとつながる大きな教訓となりました。
分子標的薬と免疫チェックポイント阻害剤
がん治療は近年、大きな進化を遂げており、特に「分子標的薬」と「免疫チェックポイント阻害剤」は、従来の化学療法とは異なるアプローチでがんを抑制する新しい治療法として注目されています。
これらの治療法は、がん細胞の特性や患者さまの免疫機能を活用し、より効果的で副作用の少ない治療を目指しています。
分子標的薬とは?
分子標的薬は、がん細胞の特定の遺伝子やタンパク質を標的とすることで、がんの増殖を抑制する薬剤です。
従来の化学療法では、がん細胞だけでなく正常な細胞にも影響を与えるため、脱毛や吐き気などの副作用が強く出ることがありました。
一方で、分子標的薬は、がん細胞特有の異常な分子に作用するため、正常な細胞への影響を抑えながら治療を行うことができます。
| 分類 | 作用機序 | 代表的な薬剤 |
| EGFR阻害薬 | がん細胞の増殖シグナルを阻害する | イレッサ(ゲフィチニブ)、タルセバ(エルロチニブ) |
| HER2阻害薬 | HER2陽性の乳がんや胃がんの増殖を抑える | ハーセプチン(トラスツズマブ)、パージェタ(ペルツズマブ) |
| VEGF阻害薬 | 血管新生を抑え、がん細胞への栄養供給を制限 | アバスチン(ベバシズマブ) |
| ALK阻害薬 | ALK遺伝子変異を持つ肺がんの増殖を抑制 | ザーコリ(クリゾチニブ)、アレセンサ(アレクチニブ) |
分子標的薬は、がんの種類や遺伝子変異の有無によって適応が決まるため、治療前に遺伝子検査を行うことが一般的です。
免疫チェックポイント阻害剤とは?
免疫チェックポイント阻害剤は、がん細胞が免疫細胞の攻撃を逃れる仕組みをブロックすることで、免疫システムを活性化し、がん細胞を排除する治療法です。
T細胞(免疫細胞の一種)はがん細胞を攻撃する働きを持っていますが、がん細胞は「免疫チェックポイント」という機構を利用してT細胞の働きを抑制します。免疫チェックポイント阻害剤は、この抑制を解除し、免疫細胞の攻撃力を回復させます。
| 薬剤名 | 標的分子 | 適応がん種 |
| オプジーボ(ニボルマブ) | PD-1 | 非小細胞肺がん、腎細胞がん、悪性黒色腫(メラノーマ)など |
| キイトルーダ(ペムブロリズマブ) | PD-1 | 非小細胞肺がん、胃がん、頭頸部がん、ホジキンリンパ腫など |
| ヤーボイ(イピリムマブ) | CTLA-4 | 悪性黒色腫(メラノーマ)など |
免疫チェックポイント阻害剤の登場は、従来の治療では効果が期待しづらかった進行がんや転移がんの患者さまに、新たな治療の可能性をもたらしました。
特に、肺がんや悪性黒色腫(メラノーマ)においては、劇的な効果を示すケースもあり、長期生存が期待されるようになっています。
分子標的薬と免疫チェックポイント阻害剤の違い
以下に、「分子標的薬」と「免疫チェックポイント阻害剤」の違いについてまとめました。
| 項目 | 分子標的薬 | 免疫チェックポイント阻害剤 |
| 作用機序 | がん細胞の特定の分子を標的にして攻撃 | 免疫細胞の働きを強化し、がん細胞を攻撃 |
| 対象がん種 | 遺伝子変異を持つ特定のがん | 免疫応答が関与する幅広いがん |
| 適応の判断 | 遺伝子検査が必要 | PD-L1発現やTMB(腫瘍変異負荷)の検査が必要 |
| 治療の持続性 | 効果が出やすいが、耐性が生じることがある | 効果が出るまで時間がかかるが、長期効果が期待できる |
分子標的薬は、特定の遺伝子異常を持つがん細胞に高い効果を発揮しますが、長期間使用すると耐性が生じ、効果が低下することがあります。
一方、免疫チェックポイント阻害剤は、一部の患者さまには劇的な効果を示しますが、すべての患者さまに有効ではなく、免疫関連の副作用(自己免疫疾患のような症状)が出る可能性があります。
最新の免疫療法
がん治療の進歩により、免疫療法はますます重要な治療法として注目されています。
免疫療法は、がん細胞を直接攻撃するのではなく、患者さま自身の免疫システムを活性化させることでがんを排除する新たなアプローチです。
免疫療法は従来の化学療法や放射線治療とは異なり、がん細胞を特異的に攻撃し、副作用を抑えながら長期的な効果を期待できる治療法とされています。
免疫細胞の働きを活性化させ、がん細胞を効果的に攻撃できるようにすることが免疫療法の目的です。
ここからは、最新の免疫療法の中でも特に注目されている6種複合免疫療法の最新情報について、詳しく解説します。
副作用が少ない6種複合免疫療法

「6種複合免疫療法」の特徴を3つ紹介します。
①副作用が少なく、体への負担が小さい治療法である
患者さまご自身の免疫細胞を使用するため、抗がん剤のような強い副作用がほとんどありません。
そのため、他のがん治療で治療継続は困難と判断された場合でも、6種複合免疫療法なら治療を継続できる可能性があります。
②がん3大療法との併用が可能で、ほぼ全てのがんに対応する
がん3大療法(外科手術/化学療法/放射線治療)との併用が可能で、一部(T細胞・NK細胞・NKT細胞型白血病/T細胞・NK細胞・NKT細胞型悪性リンパ腫)を除く、ほぼ全てのがんに対応します。
また、手術後に残ったがん細胞にも対応し、がん細胞増殖の抑制、再発・転移の予防にも効果的です。
③入院が必要ないため、患者さまの生活のリズムを変えることなく治療を行うことができる
6種複合免疫療法は、採血と点滴だけの通院治療です。
そのため、入院の必要がなく、患者さまの生活のリズムを変えることなく治療を行うことができます。
6種複合免疫療法の治療効果
以下は、6回(1クール)の治療を終えた患者さまの治療効果です。
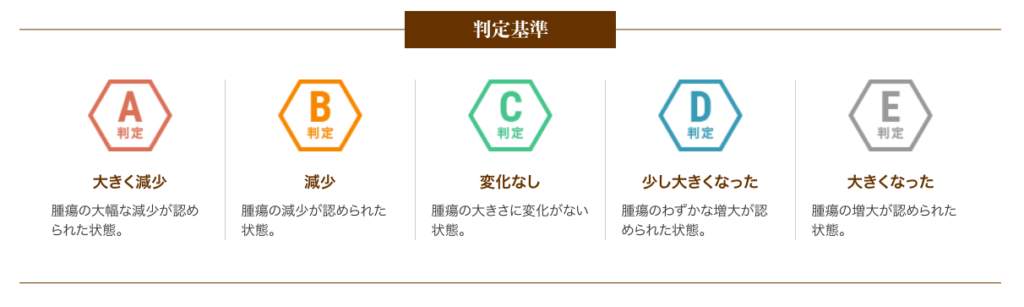

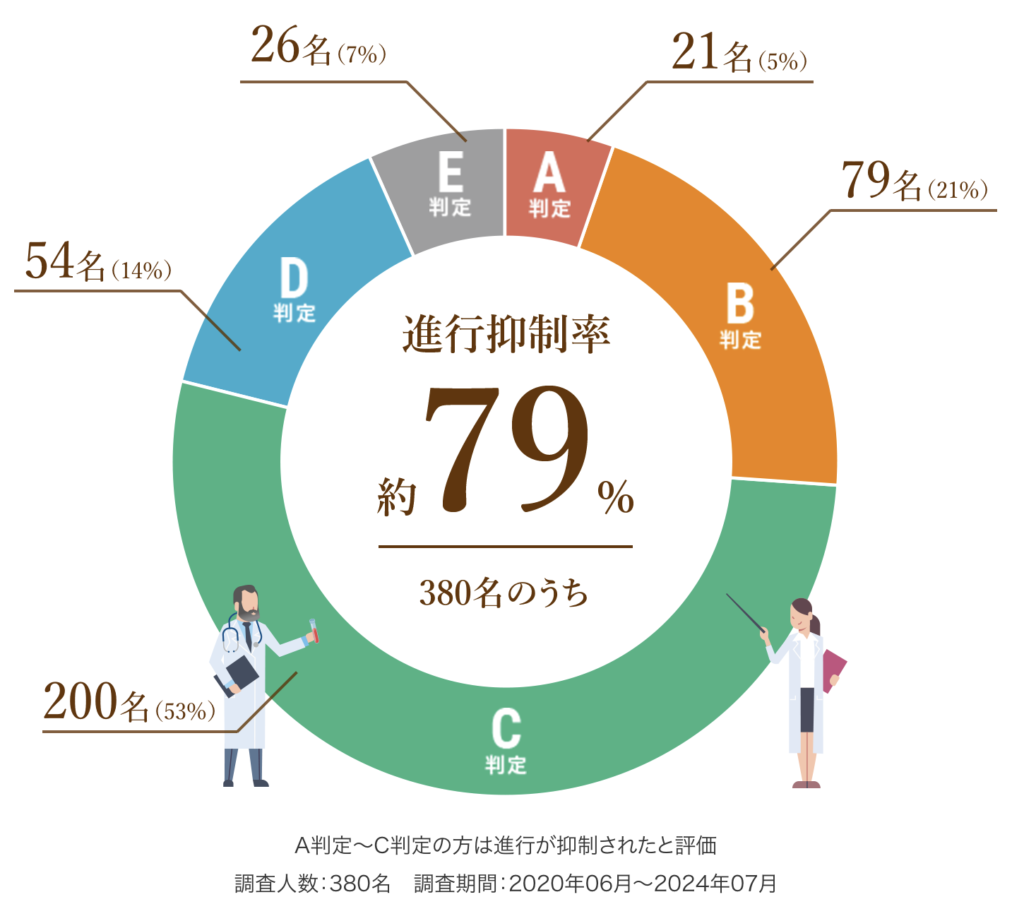
A判定〜C判定の約79%の方は腫瘍の進行が抑制されたと評価し、さらにA判定〜B判定の約26%の方は腫瘍の減少が認められた状態となりました。
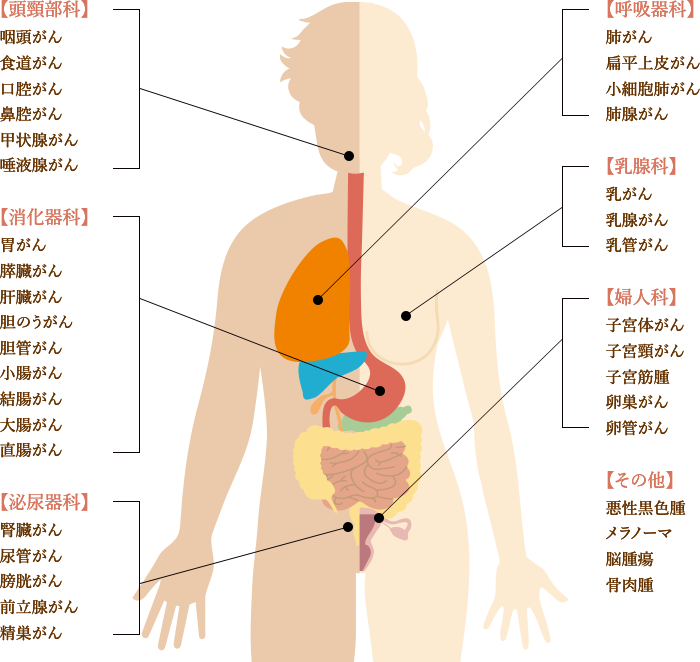
また、6種複合免疫療法の大きな特徴として、さまざまな部位のがんに対応できるという点があります。
以下、6種複合免疫療法で過去に治療したがんの一例です。ほぼ全てのがん種に対応しているため、以下に記載のないがん種や希少がんでも、治療可能です。
詳細は以下よりお問い合わせください。
お電話でのお問い合わせ
専任のスタッフが丁寧に対応いたします。
ご不明な点などございましたら、まずはお気軽にご相談ください。
0120-350-552
受付時間月曜〜金曜/09:00 - 18:00
土曜/09:00 - 13:00